Wenn Blutgefäße entzündet werden, ist das kein gewöhnlicher Infekt. Es ist ein Angriff des eigenen Körpers auf sich selbst. Bei Vasculitis greift das Immunsystem fälschlicherweise die Wände der Blutgefäße an. Das führt zu Entzündungen, die das Gefäß verengen, verschließen oder sogar reißen lassen. Die Folge: Organe bekommen nicht mehr genug Sauerstoff und Nährstoffe. Je nachdem, welche Gefäße betroffen sind, kann das lebensbedrohlich sein - besonders wenn Gehirn, Nieren oder Lunge betroffen sind.
Was genau passiert bei Vasculitis?
Vasculitis ist keine einzige Krankheit, sondern eine Gruppe von über 20 verschiedenen Erkrankungen. Alle haben eines gemeinsam: Die Blutgefäße werden von weißen Blutkörperchen angegriffen. Diese Entzündung kann an jeder Stelle im Körper auftreten - von der großen Aorta bis zu den kleinsten Kapillaren. Die Folge ist immer die gleiche: Das Gefäß wird dicker, verengt sich, bildet Geschwüre oder sogar ein Aneurysma. Wenn ein Blutgefäß komplett verschlossen ist, stirbt das Gewebe dahinter ab. Das nennt man Ischämie. Wenn es platzt, kommt es zu Blutungen.
Die Entzündung verläuft in Stufen. Zuerst sammeln sich neutrophile Granulozyten an der Gefäßwand. Später kommen Lymphozyten dazu. In schweren Fällen wird das Gefäßgewebe durch Fibrin abgebaut - das ist der sogenannte fibrinoide Nekrose. Besonders gefährlich ist das bei mittelgroßen Arterien, denn dort wird die elastische Lamelle zerstört. Das ist die Schicht, die das Gefäß stabil hält. Ohne sie kann sich das Gefäß ausdehnen und ein Aneurysma bilden - ein Zeitbombe, die jederzeit platzen kann.
Wie wird Vasculitis klassifiziert?
Ärzte teilen Vasculitis nach der Größe der betroffenen Gefäße ein. Das ist wichtig, weil die Behandlung davon abhängt.
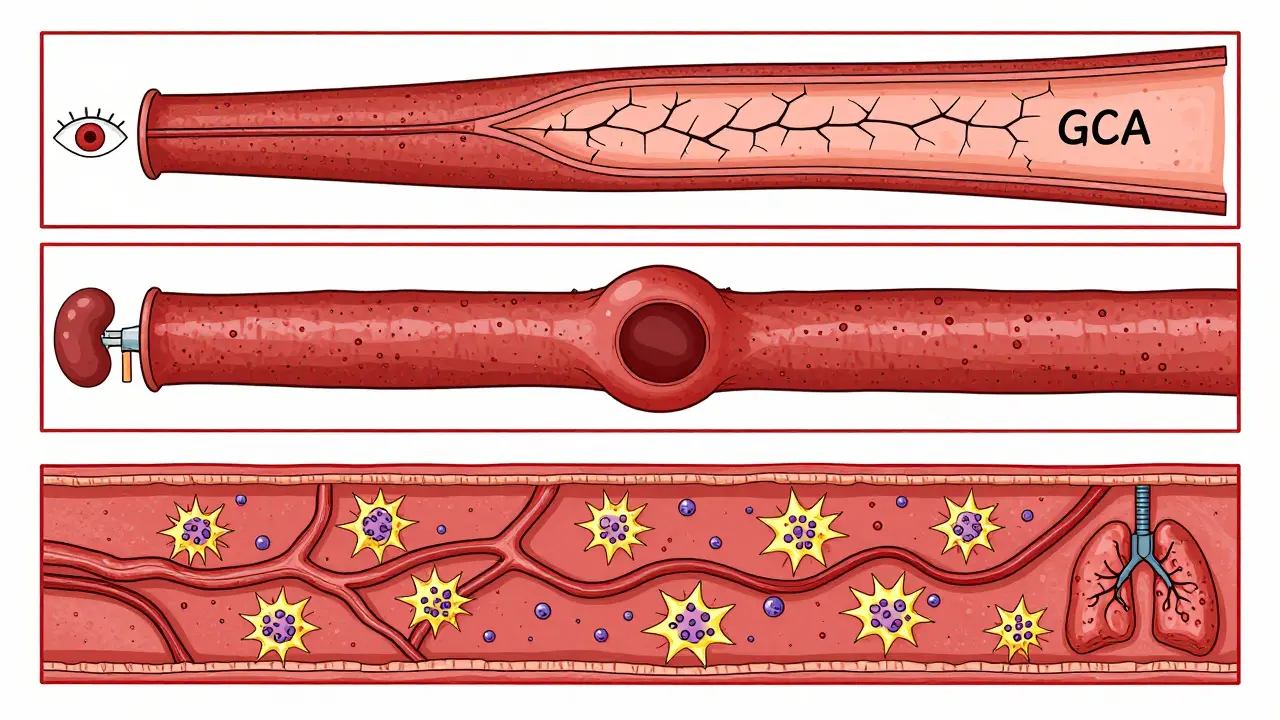
- Großgefäß-Vasculitis: Betroffen sind die großen Arterien wie die Aorta oder ihre Hauptäste. Zu dieser Gruppe gehören die Gigantzellarteriitis (GCA) und die Takayasu-Arteriitis. Die Gigantzellarteriitis trifft meist Menschen über 50. Sie greift besonders die Schläfenarterien an. Betroffene haben starke Kopfschmerzen, verschwommenes Sehen oder sogar plötzliche Erblindung.
- Mittelgefäß-Vasculitis: Hier geht es um die Arterien der Muskulatur, des Darmes oder der Nieren. Die Polyarteritis nodosa ist ein typisches Beispiel. Sie kann Bauchschmerzen, Nierenversagen oder Nervenschäden verursachen. Bei Kindern ist die Kawasaki-Krankheit die häufigste Form. Sie kann zu Aneurysmen in den Herzkranzgefäßen führen - das ist lebensgefährlich, wenn sie nicht rechtzeitig behandelt wird.
- Kleingefäß-Vasculitis: Das sind die kleinsten Gefäße: Kapillaren, Arteriolen, Venolen. Hier treten die ANCA-assoziierten Erkrankungen auf: Granulomatose mit Polyangiitis (GPA), Microskopische Polyangiitis (MPA) und Eosinophile Granulomatose mit Polyangiitis (EGPA, früher Churg-Strauss). Diese Formen greifen oft Lunge und Nieren an. MPA ist besonders häufig mit Nierenversagen verbunden. EGPA verläuft oft mit Asthma und hohen Eosinophilen im Blut.
Andere Formen wie die Behçet-Krankheit oder die Buerger-Krankheit (Thromboangiitis obliterans) gehören zu Sonderfällen. Letztere tritt fast nur bei Rauchern auf und zerstört die Gefäße an Händen und Füßen. Hier hilft nur eines: sofort mit dem Rauchen aufhören. Alle anderen Behandlungen sind dann sinnlos.
Welche Symptome weisen auf Vasculitis hin?
Die Anzeichen sind vielfältig und oft unspezifisch. Deshalb dauert es oft sechs bis zwölf Monate, bis die Diagnose gestellt wird. Viele Patienten werden zunächst als Grippe, Rheuma oder Lungenentzündung behandelt - mit falschen Ergebnissen.
- Haut: Rote oder violette Flecken, Knötchen, Blutergüsse, Urtikaria - besonders an den Beinen.
- Gelenke: Schmerzen, Schwellungen, steife Finger oder Zehen - ähnlich wie bei Arthritis.
- Lunge: Husten, Atemnot, Blut im Auswurf. Bei GPA kann es zu Lungenblutungen kommen.
- Nieren: Oft keine Schmerzen, aber Blut oder Eiweiß im Urin. Das ist ein Warnsignal, das viele übersehen.
- Nerven: Taubheit, Kribbeln, Schwäche in Armen oder Beinen. Das kommt von Nervenentzündung durch eingeklemmte Gefäße.
- Bauch: Starke Schmerzen, Übelkeit, Blut im Stuhl - besonders bei Mittelgefäß-Vasculitis.
- Augen: Verschwommenes Sehen, Schmerzen, plötzliche Sehstörungen - bei Gigantzellarteriitis ein Notfall.
Ein Patient mit MPA kann monatelang nur müde sein und Rückenschmerzen haben. Ein anderer mit GPA entwickelt plötzlich Husten mit Blut. Deshalb ist es so schwer, Vasculitis zu erkennen. Aber: Wenn mehrere Organe betroffen sind und Entzündungswerte hoch sind, sollte man an Vasculitis denken.
Wie wird Vasculitis diagnostiziert?
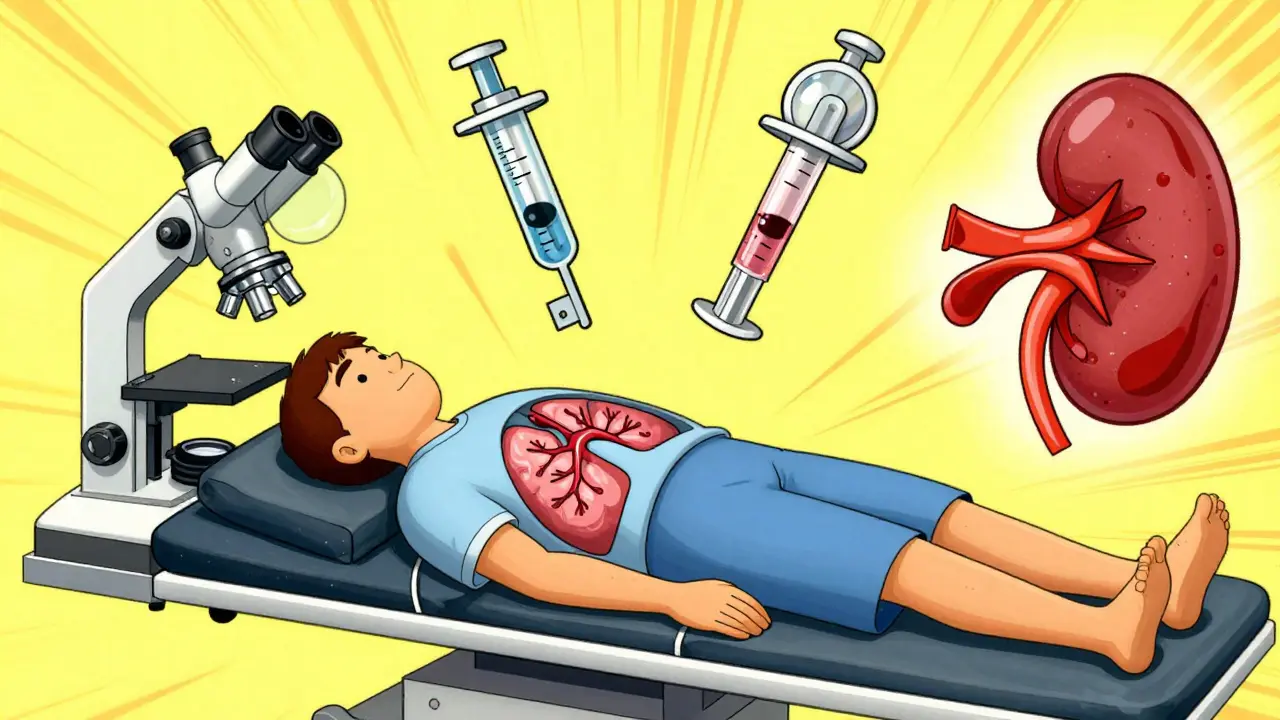
Es gibt keinen einzigen Test. Die Diagnose ist wie ein Puzzle. Drei Säulen müssen passen: Symptome, Blutwerte und Gewebeprobe.
- Bluttests: ESR (Blutsenkungsgeschwindigkeit) über 50 mm/Stunde und CRP über 5 mg/dL sind starke Hinweise. Aber auch normale Werte schließen Vasculitis nicht aus.
- ANCA-Antikörper: Diese Antikörper sind ein Schlüssel. c-ANCA (gegen Proteinase-3) ist in 80-90 % der Fälle bei GPA positiv. p-ANCA (gegen Myeloperoxidase) kommt oft bei MPA und EGPA vor. Aber: Nicht jeder, der ANCA hat, hat Vasculitis. Und nicht jeder mit Vasculitis hat ANCA.
- Bildgebung: Ultraschall, CT oder MRT zeigen verengte oder erweiterte Gefäße. Bei Gigantzellarteriitis kann ein Temporalarterien-Ultraschall typische Veränderungen zeigen.
- Gewebeprobe (Biopsie): Das ist der Goldstandard. Wenn Haut, Niere, Lunge oder Nerven betroffen sind, nimmt man eine Probe. Unter dem Mikroskop sieht man die Entzündung in der Gefäßwand, oft mit Zelltrümmern (leukoklastische Vasculitis). Bei Nierenbeteiligung ist eine Nierenbiopsie entscheidend.
- Urinuntersuchung: Blut oder Eiweiß im Urin sind ein Warnsignal für Nierenbeteiligung - auch wenn der Patient sich gut fühlt.
Die Five-Factor-Score-Skala hilft, das Risiko einzuschätzen: Wenn Niere, Herz, Darm oder andere Organe betroffen sind, steigt das Sterberisiko. Ein Score von 0 bedeutet eine 95 %ige Überlebenschance über fünf Jahre. Ein Score von 2 oder mehr sinkt auf unter 50 %.
Wie wird Vasculitis behandelt?
Die Behandlung hat zwei Ziele: Die Entzündung stoppen und langfristig Remission erreichen - ohne dauerhafte Schäden.
- Starke Entzündung (Induktion): Hochdosiertes Kortison (Prednison 0,5-1 mg/kg pro Tag) wird kombiniert mit Cyclophosphamid oder Rituximab. Rituximab ist ein Antikörper, der B-Zellen abbaut - die Zellen, die die ANCA produzieren. Diese Kombination bringt in 80-90 % der Fälle eine Remission.
- Steroid-sparende Therapie: Seit 2021 gibt es Avacopan. Das ist ein neues Medikament, das den Entzündungsfaktor C5a blockiert. Es ersetzt Kortison nicht vollständig, aber es reduziert die Gesamtmenge um etwa 2.000 mg über ein Jahr. Das bedeutet weniger Nebenwirkungen: weniger Gewichtszunahme, Knochenverlust, Diabetes-Risiko.
- Langzeittherapie (Erhaltung): Nach der Remission dauert die Behandlung 18-24 Monate. Dann wechselt man auf Azathioprin, Methotrexat oder Rituximab. Rituximab wird alle sechs Monate wiederholt - das reduziert das Rückfallrisiko.
- Gigantzellarteriitis: Kortison bleibt die Basis. Aber seit 2023 ist Tocilizumab zugelassen - ein Antikörper gegen IL-6. Er hilft, die Kortison-Dosis schneller zu senken und Rückfälle zu verhindern.
- EGPA: Mepolizumab, ein Antikörper gegen Interleukin-5, wird in Studien geprüft. Er senkt die Eosinophilen und reduziert Rückfälle um 50 %.
- Buerger-Krankheit: Nur ein Weg: Rauchen aufhören. Kein Medikament hilft, wenn man weiter raucht.
Die Behandlung ist nicht einfach. Kortison kann Knochen brechen, Infektionen begünstigen, das Immunsystem unterdrücken. Deshalb ist die Kombination mit gezielten Antikörpern heute der Standard - nicht nur wegen der Wirksamkeit, sondern wegen der Sicherheit.
Wie ist die Prognose?
Die Aussichten sind heute besser als je zuvor. Mit richtiger Behandlung erreichen 80-90 % der Patienten eine Remission. Aber: Die Krankheit kommt zurück. Etwa die Hälfte aller Patienten erlebt innerhalb von fünf Jahren einen Rückfall. Deshalb ist die Langzeitbetreuung wichtig - nicht nur Medikamente, sondern regelmäßige Kontrollen: Blut, Urin, Blutdruck, Nierenwerte, Lunge.
Bei Gigantzellarteriitis ist die Prognose gut, wenn die Behandlung früh beginnt. Ohne Behandlung kann es zu Erblindung kommen. Bei MPA mit Nierenversagen ist die Überlebensrate viel niedriger - aber mit Dialyse und Immunsuppressiva können viele Patienten ein normales Leben führen. Bei Kawasaki-Krankheit ist die Frühbehandlung mit Immunglobulinen entscheidend. Ohne sie entwickeln 20-25 % der Kinder Aneurysmen in den Herzkranzgefäßen - das kann Jahre später zu Herzinfarkten führen.
Die wichtigste Botschaft: Vasculitis ist behandelbar, aber nicht heilbar. Es ist eine chronische Erkrankung, die mit Medikamenten kontrolliert werden kann. Wer früh erkannt wird, hat eine gute Zukunft. Wer zu lange wartet, riskiert bleibende Schäden - und manchmal den Tod.
Was passiert in der Forschung?
Die Forschung geht in zwei Richtungen: Bessere Diagnose und personalisierte Therapie.
- Biomarker: Wissenschaftler suchen nach Molekülen, die vor einem Rückfall warnen. BAFF (B-Zell-aktivierender Faktor) und MCP-1 (im Urin) könnten zukünftig zeigen, wann eine Behandlung wieder nötig ist - ohne auf Symptome zu warten.
- Neue Medikamente: Abatacept, ein Medikament, das T-Zellen hemmt, wird bei Gigantzellarteriitis getestet. Wenn es funktioniert, könnte es Kortison in Zukunft ersetzen.
- Genetik: Bestimmte Gene erhöhen das Risiko. Wer diese kennt, kann früher reagieren.
Die Zukunft liegt in der Präzisionsmedizin: Nicht mehr „eine Behandlung für alle“, sondern „die richtige Therapie für den richtigen Patienten“ - basierend auf seinem Typ, seinen Genen und seinen Blutwerten.
